- дослідження особливостей фізико-хімічного стану фосфоліпідного бішару мембран клітин;
- вивчення особливостей клітинної смерті (апоптоз, некроз, аутофагія тощо);
- дослідження ролі кальцій-залежних шляхів активації ериптозу;
- вивчення динаміки розподілу біомолекул в організмі;
- дослідження змін конформації та особливостей фолдінгу білків;
- вивчення редокс-гомеостазу клітин;
- оцінка мітохондріальної функції клітин.
Спектральний діапазон збудження: 200–900 нм. Спектральний діапазон випромінення: 200–900 нм. Монохроматори: решітки 1200 штрихів/мм. Детектор: фотоелектронний помножувач (ФЕП) R928. Джерело збудження: Ксенонова дугова лампа на 150 Вт. Відношення сигнал/шум краще ніж 4000:1 (RMS). Точність встановлення довжини хвилі: 0,5 нм. Відтворюваність довжини хвилі: 0,2 нм. Дозволяє вимірювати флуоресценцію біологічних рідин, а також флуоресценцію зондів та міток.
Флуоресцентні зонди O1O (2-(2¢-гідрокси-феніл)-5-феніл-1,3-оксазол, O6O (2-(2¢-гідрокси-феніл)-5-(4¢-біфеніл)-1,3 -оксазол і PH7 (2-(2¢-гідрокси-феніл)-фенантро [9,10-d]-1,3-оксазол) можуть виявляти зміни в гідратації ліпідного бішару клітинної мембрани і, таким чином, можуть вказують на зміни в упорядкованості мембранних ліпідів.
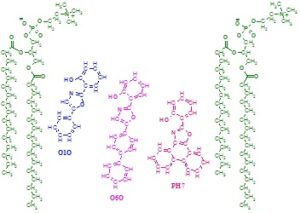
Локалізація та орієнтація флуоресцентних зондів O1O, O6O та PH7 у зовнішньому шарі фосфоліпідних мембран. Наведено дві молекули 1,2-дипальмітоїл-фосфатидилхоліну, щоб показати розташування та орієнтацію зондів.

